Hematologia laboratoryjna
Hematologia Laboratoryjna
IVrok, kierunek Analityka medyczna,
rok akademicki 2022/2023, semestr zimowy i letni
Osoba odpowiedzialna za dydaktykę: mgr Agnieszka Wiśniewska (agnieszka.wisniewska@wum.edu.pl)
Miejsce i wymiar zajęć z Analityki ogólnej:
Zajęcia obejmują 180 godzin, w tym: wykłady 60, seminaria 30, ćwiczenia 90
ECTS = 16.
Ćwiczenia w salach mikroskopowych Zakładu Medycyny Laboratoryjnej WUM (Banacha 1a, blok C, niski parter),

Seminaria Sala C, Wydział Farmaceutyczny
Wykłady
W czasie rzeczywistym MS Teams
Forma zaliczenia przedmiotu: Egzamin ustny i testowy w sesji letniej
Cel nauczania i zakres przedmiotu
Celem nauczania Hematologii Laboratoryjnej jest:
· Nabycie umiejętności bezpiecznej pracy w laboratorium w pracowni mikroskopowej z materiałem pacjenta.
· Nabycie umiejętności pracy z mikroskopem świetlnym.
· Zapoznanie się z podstawowymi technikami automatycznymi i manualnymi stosowanymi w pracowni hematologii.
· Nabycie umiejętności samodzielnego wykonania rozmazów krwi obwodowej i szpiku.
· Nabycie umiejętności samodzielnego liczenia i interpretacji rozmazów krwi obwodowej
· Nabycie umiejętności samodzielnego liczenia i interpretacji mielogramów.
· Nabycie umiejętności bezpiecznej pracy w laboratorium.
· Godziny przyjęć studentów uzgadniane na bieżąco w sekretariacie
Wszystkie informacje przeznaczone dla studentów zamieszczane są na tablicy ogłoszeń na bieżąco.
Tematy wykładów:
1. ,,Od młokosa do herosa” wstęp do hematopoezy. Mgr Agnieszka Wiśniewska
2. Z cyklu - ,,Od młokosa do granuloherosa”- omówienie hematopoezy z uwzględnieniem szczegółowej morfologii komórek układu białokrwinkowego (układu granulocytarnego, mono- i limfoidalnego). Mgr Agnieszka Wiśniewska.
3. Z cyklu - ,,Od młokosa do hemoherosa” – omówienie hematopoezy układu czerwonokrwinkowego z uwzględnieniem szczegółowej morfologii poszczególnych komórek. Mgr Agnieszka Wiśniewska.
4. Zmiany ilościowe i jakościowe elementów morfotycznych krwi. Mgr Agnieszka Wiśniewska
5. Hematologia Laboratoryjna w Polsce i na świecie. Mgr Agnieszka Wiśniewska
6. Metody instrumentalne automatyczne i manualne stosowane we współczesnej diagnostyce hematologicznej. Mgr Agnieszka Wiśniewska
7. Niedokrwistości i ich podział. Dr hab. Olga Ciepiela
8. Niedokrwistości mikrocytarna niedoborowa, pokrwotocza i chorób przewlekłych. Dr hab. Olga Ciepiela
9. Niedokrwistości makrocytarne ( megaloblastyczne vs makrocytarne). Dr hab. Olga Ciepiela
10. O niedokrwistościach hemolitycznych z polichromatofilami, sferocytami i retikulocytami w tle. Dr hab. Olga Ciepiela
11. Co się kryje pod pojęciem retikulocytoz i retikulocytopenii. Mgr Agnieszka Wiśniewska
12. Aplazja szpiku – przyczyny i konsekwencje. Mgr Milena Małecka-Giełdowska
13. Wstęp do laboratoryjnej diagnostyki zaburzeń układu hemostazy. Fizjologia układu krzepnięcia krwi. Mgr Paweł Kozłowski
14. Skazy krwotoczne - podział i rola diagnostyki laboratoryjnej w ich rozpoznawaniu. Mgr Paweł Kozłowski
15. Zakrzepica i trombofilia - podstawowe informacje i obowiązujące algorytmy diagnostyczne. Mgr Paweł Kozłowski
16. Monitorowanie leczenia przeciwkrzepliwego - antagoniści witaminy K, heparyny, nowe doustne antykoagulanty. Mgr Paweł Kozłowski
17. ‘’Najmniejsze ale czy nie najważniejsze – o trombocytach prawie wszystko’’. Mgr Agnieszka Wiśniewska
18. ,,O przewlekłej białaczce szpikowej i jej konsekwencjach nie szpikowych’’. Dr Emilia Czyżewska
19. „Czy choroby mieloproliferacyjne to nowotwory?’’. Dr Emilia Czyżewska
20. ‘’Mielodysplazja, erytrodysplazja, megalodysplazja … czyli Zespoły Mielodyspalastyczne’’ Dr Emilia Czyżewska
21. „Dlaczego białaczki mieloblastyczne są białaczkami ostrymi’’. Mgr Milena Małecka-Giełdowska
22. „Co się kryje pod skrótem ALL’’. Mgr Milena Małecka-Giełdowska
23. Do czego prowadzi rozrost linii limfoidalnej. Mgr Agnieszka Wiśniewska
24. Gdzie się rozwijają Chłoniaki. Mgr Agnieszka Wiśniewska
25. Szpiczak nie ma sobie równych pod mikroskopem i w elektroforezie o Plazmocytomie i innych gammapatiach. Dr hab. Olga Ciepiela
26. Przeciwciała monoklonalne i fluorescencja w rękach diagnosty hematologa – wstęp do cytometrii przepływowej. Dr hab. n. med. Olga Ciepiela
27. Diagnostyka cytometryczna w chorobach hematologicznych. Dr hab. n. med. Olga Ciepiela
28. Diagnostyka molekularna w służbie hematologii. Mgr Agnieszka Wiśniewska
29. Jak rozpoznać stany nagłe w hematologii. Mgr Agnieszka Wiśniewska
30. Podstawy interpretacji wyników morfologii i mielogramów. Mgr Agnieszka Wiśniewska
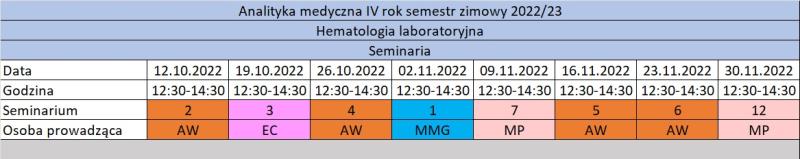
Tematy seminariów:
1. Co się kryje pod 28 parametrowym wynikiem morfologii.
2. Hematologiczne osobliwości w pediatrii i w wieku starczym.
3. Czy leki, temperatura, papierosy i inne używki mogą wywołać u nas choroby krwi?
4. Wybrane praktyczne problemy u pacjentów z chorobami krwi.
5. Narządowe objawy chorób krwi i układu krwiotwórczego.
6. Badania bioptyczne układu krwiotwórczego.
7. Problemy hematologiczne w położnictwie i ginekologii.
8. Transplantacja komórek macierzystych.
9. Zaburzenia układu hemostazy okiem praktyka.
10. Metody stosowane w laboratoryjnej diagnostyce układu hemostazy.
11. Amyloidoza pierwotna.
12. Nieprawidłowości w syntezie hemu i metabolizmie żelaza.
13. Terapia genowa w chorobach hematologicznych, zakażeniach HIV i w nowotworach.
14. Krioglobuliny, krioglobulinemia i inne czynniki interferujące w oznaczeniach hematologicznych.
15. Badania krwinek czerwonych.
Tematy ćwiczeń:
1. Zajęcia organizacyjne |
2. Zapoznanie się z układem białokrwinkowym krew obwodowa/ szpik |
3. Zapoznanie się z układem czerwonokrwinkowym i płytkowym w szpiku |
4. Poznawanie morfologii prawidłowych leukocytów krwi obwodowej |
5. Nauka wykonywania rozmazów krwi obwodowej (grupa 5-osobowa) |
6. Nauka liczenia prawidłowych rozmazów krwi obwodowej (grupa 5-osobowa) |
7. Ocena jakościowa krwinek czerwonych w rozmazach |
8. Automatyczna i manualna ocena liczby retikulocytów |
9. Ocena mikroskopowa rozmazów krwi w stanach zapalnych |
10.Mielogram – samodzielna ocena (grupa 5 osobowa) |
11.Samodzielna ocena preparatów krwi obwodowej i szpiku (grupa 5 osobowa) |
12. Odmłodzenie układu białokrwinkowego /left shift/ ocena wyniku, rozmazu i szpiku |
13. Niedokrwistości mikrocytowe – ocena rozmazów krwi i szpiku |
14. Niedokrwistości makrocytowe – ocena rozmazów krwi i szpiku |
15. Niedokrwistości chorób przewlekłych - ocena rozmazów krwi i szpiku |
16. Niedokrwistości hemolityczne - ocena rozmazów krwi i szpiku |
17. Erytroblasty i paraerytroblasty w rozmazach krwi obwodowej i szpiku |
18. Kolokwium pisemne I -3 pytania otwarte/ Analiza wybranych rozmazów krwi i szpiku z zakresu ćwiczeń 9-17 |
19. Ćwiczenia z hemostazy na pracowni koagulologicznej |
20. Płytki w rozmazach krwi obwodowej i w szpiku w różnych stanach chorobowych |
21. Szpiczak plazmocytowy – ocena rozmazów krwi i szpiku, interpretacja wyników badań laboratoryjnych |
22. Przewlekła białaczka szpikowa, przewlekłe zespoły mieloproliferacyjne- ocena rozmazów mikroskopowych krwi i szpiku |
23. Ostre białaczki w rozmazach krwi i szpiku |
24. Ostre białaczki limfoblastyczne – ocena rozmazów krwi i szpiku |
25. Przewlekłe białaczki limfocytowe – ocena rozmazów krwi i szpiku |
26. Chłoniaki - ocena szpiku i krwi obwodowej |
27. Kolokwium II - 3 pytania otwarte/ Analiza wybranych rozmazów krwi i szpiku z zakresu ćwiczeń 20-26 |
28. Zespoły mielodysplastyczne – ocena rozmazów krwi i szpiku |
29. Interpretacja wyników morfologii uzyskanych metodą automatyczną z weryfikacją mikroskopową. |
30. Zaliczenie praktyczne ćwiczeń - ocena 3 rozmazów krwi i szpiku |
Metody organizacji pracy: Studenci pracują samodzielnie, wykonując praktycznie zadania przewidziane programem.
Organizacja zajęć:
Ćwiczenia w Sali mikroskopowej będą odbywać się w 4 grupach (lub 8 grupach 5-osobowych – ćwiczenie 5,6,10,11)
Wykłady będą się odbywały w formie e-learningu.
Warunkiem zaliczenia przedmiotu jest udział we wszystkich wykładach, obecność na co najmniej 14 seminariach i 28 ćwiczeniach (dopuszczalna jedna nieobecność w semestrze), zaliczenie kartkówek, zaliczenie kolokwiów, egzaminu praktycznego oraz egzaminu końcowego.
Formy kontroli i ocena wyników nauczania:
Kartkówki (wejściówki) przed rozpoczęciem ćwiczeń – co najmniej 10 razy
Kolokwia zgodnie z planem zajęć
Zaliczenie praktyczne ćwiczeń na ostatnich zajęciach ćwiczeniowych.
Egzamin ustny i testowy w sesji letniej 2023
Literatura obowiązkowa:
Hematologia, Wielka Interna tom 10, Warszawa 2011.
Podstawowe laboratoryjne badania hematologiczne, H. Bomski, PZWL, 1998.
Atlas Hematologiczny z elementami diagnostyki laboratoryjnej i hemostazy, M Kozłowska-Skrzypczak, A. Czyż, E. Wojtasińska, PZWL, 2016.
Podstawy hematologii, red. A. Dmoszyńska, wydawnictwo Czelej, wydanie III.
Literatura polecana:
Diagnostyka Laboratoryjna , red. U. Demkow, WUM.
Diagnostyka Laboratoryjna, B. Solnica, PZWL, Warszawa 2014, rozdz. 8. Diagnostyka laboratoryjna chorób układu krwiotwórczego.
Interna Szczeklika 2016, rozdział VI.
Podstawy medycyny wewnętrznej Harrisona, część V Hematologia i onkologia, 267-369,PZWL Warszawa 2000.
Hematologia w praktyce, K. Sułek, PZWL, Warszawa 2007.
Diagnostyka cytomorfologiczna szpiku, K. Sułek, wyd. Selezjańskie, 2003.
Hematologia, L. Waterbury, Urban &Partner, Wrocław 1998.
Hematologia Kliniczna, red. K. Janicki.
